Электронное строение атома.
одной из первых моделей - орбитальной модели Бора (рис. 2-6).

Рис. 2-6. Схематичное изображение строения электронной оболочки атома в модели Бора.
Как уже упоминалось в этой главе, в 1913 году датский физик Н. Бор предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Н. Бор в то время объяснить не мог. Но он выяснил, что такая модель позволяет объяснить многие экспериментальные факты (подробнее об этом рассказывается в параграфе 2.7).
Электронные орбиты в модели Бора обозначаются целыми числами 1, 2, 3, … n, начиная от ближайшей к ядру. В дальнейшем мы будем называть такие орбиты уровнями. Уровни, в свою очередь, могут состоять из близких по энергии подуровней. Например, 2-й уровень состоит из двух подуровней (2s и 2p). Третий уровень состоит из 3-х подуровней (3s, 3p и 3d). Четвертый уровень (он не показан на рис. 2-6) состоит из подуровней 4s, 4p,4d, 4f. В параграфе 2.7 мы расскажем, откуда взялись именно такие названия подуровней и о физических опытах, которые позволили "увидеть" электронные уровни и подуровни в атомах.
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме заселяют ближайшие к ядру уровни и подуровни, потому что в этом случае их энергия меньше, чем если бы они заселяли более удаленные уровни. На каждом уровне и подуровне может помещаться только определенное количество электронов (об этом чуть ниже).
Подуровни состоят из одинаковых по энергии орбиталей (на рис. 2-6 они не показаны). Орбитали тоже удалось обнаружить экспериментально. Каждая орбиталь - это как бы "квартира" для электронов в "доме"-подуровне. Например, любой s-подуровень - это "дом" из одной "квартиры" (s-орбиталь), p-подуровни - "трехквартирные дома" (в каждом из них по три p-орбитали), d-подуровени - "дома" из 5 "квартир"-орбиталей, а f-подуровень - "дом" из 7 одинаковых по энергии орбиталей. В каждой "квартире"-орбитали могут "жить" не больше двух электронов. Запрещение электронам "селиться" более чем по-двое на одной орбитали называют запретом Паули - по имени ученого, который выяснил эту важную особенность строения атома. "Адрес" каждого электрона в атоме записывается набором квантовых чисел. Здесь мы упомянем лишь о главном квантовом числе n (см. рис. 2-6), которое в "адресе" электрона указывает номер уровня, на котором этот электрон существует.
s-, p- и d-электронов показаны на рис. 2-7.
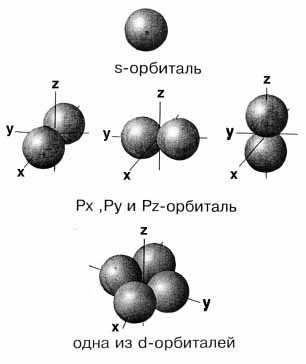
Рис. 2-7. Примерно такую форму в волновой модели атома имеют "области вероятности" существования электронов: s-, p-, и d-орбитали. Ядро атома находится в точке пересечения координат.
Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы.
Таблица 2-4. Наибольшее возможное число электронов на первых 4-х электронных уровнях.
|
Электронный уровень (n) |
Сколько может разместиться электронов на данном уровне (2n2) |
|
1 |
2 |
|
2 |
8 |
|
3 |
18 |
|
4 |
32 |
Эти сведения нам нужны для того, чтобы научиться “расселять” электроны по уровням в атоме любого элемента. А химические свойства элемента, как мы увидим чуть позже, определяются электронами самого последнего (наиболее удаленного от ядра) заселенного уровня.